Wie Helicobacter pylori Magenkrebs auslöst
FAU-Wissenschaftler entschlüsseln Mechanismus, der zur Entstehung von Magenerkrankungen durch Bakterien führt
Magenkrebs zählt zu den fünf tödlichsten Krebsarten: Jährlich sterben etwa 750.000 Patienten an dieser Erkrankung, so die Statistik der Weltgesundheitsorganisation WHO. Als Hauptauslöser gilt das Bakterium Helicobacter pylori (H. pylori). Wirkungsvolle Therapien gegen Magenkrebs gibt es derzeit nicht, zunehmende Antibiotikaresistenzen erschweren die Behandlung der Infektion zusätzlich. Forscher der FAU haben nun zwei Mechanismen entschlüsselt, die zur Entstehung von Magenkrebs durch das Bakterium führen. Ihre Erkenntnisse könnten zur Entwicklung von neuen Therapieansätzen beitragen. Die Ergebnisse haben die Wissenschaftler in der renommierten Fachzeitschrift Cell host & microbe (doi: 10.1016/j.chom.2017.09.005) veröffentlicht.
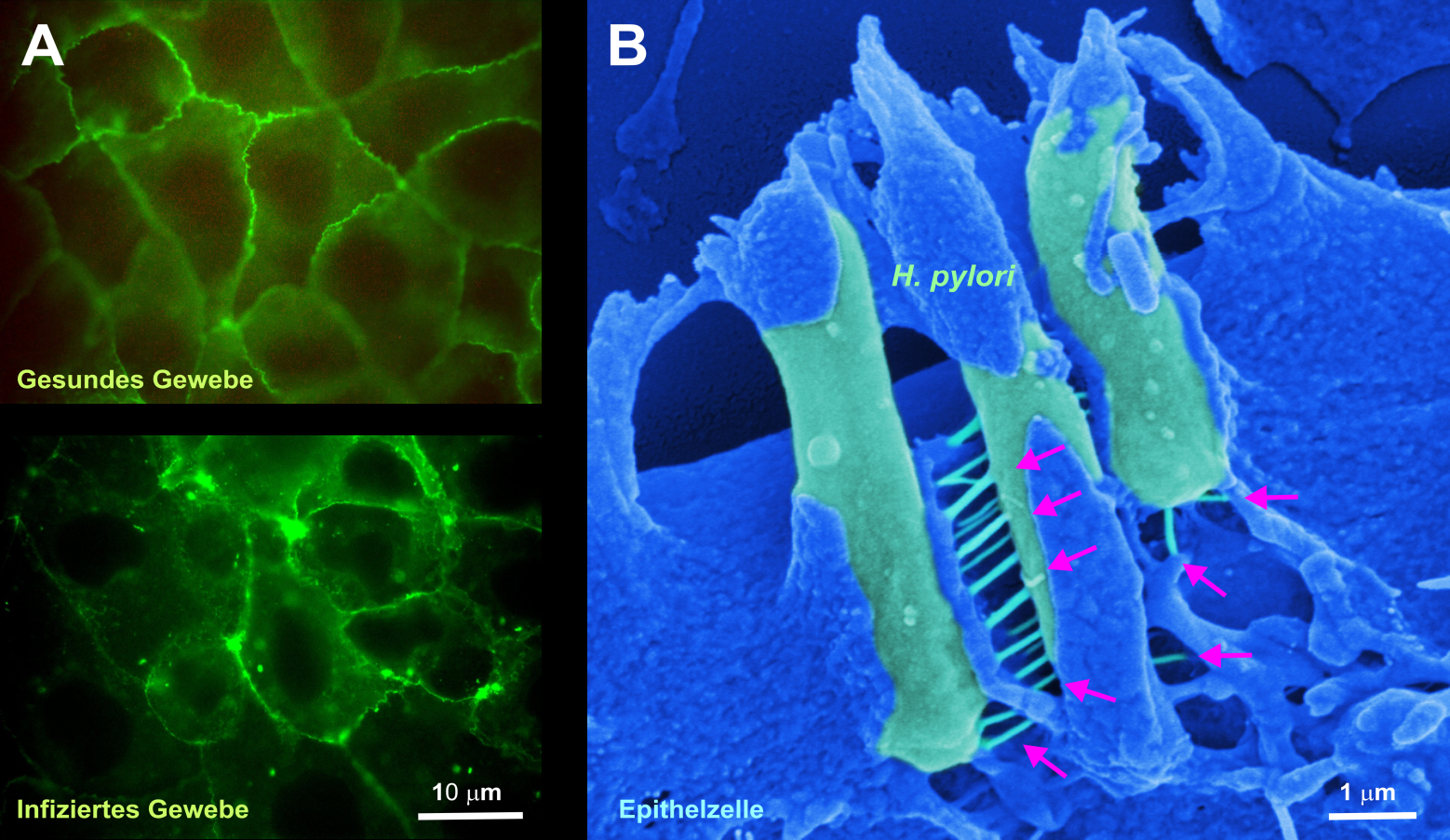
Das Team aus internationalen Wissenschaftlern um Dr. Nicole Tegtmeyer vom Lehrstuhl für Mikrobiologie der FAU hat untersucht, wie die Bakterien die Schutzschicht im Magen zerstören. Diese Schutzschicht besteht aus dicht aneinander liegenden Epithelzellen, die uns vor der Magensäure schützen. Die Forscher haben nun entdeckt, dass die H. pylori-Bakterien ein sekretiertes Enzym, die Protease HtrA, quasi als Waffe verwenden, um diese Schutzschicht zu durchbrechen: HtrA zerschneidet drei Proteine (Occludin, Claudin-8 und E-Cadherin) und erzeugt einen Durchbruch in die Schicht aus Epithelzellen. So gelangen die H. pylori-Bakterien in tiefere, normalerweise keimfreie Gewebeschichten und richten weiteren Schaden an. Damit beginnt die Entstehung von Magenkrebs.
Auf diesen ersten Schritt folgt jedoch ein noch viel gefährlicherer, wie die Wissenschaftler feststellten. Ein nadelartiger Fortsatz, den man als Typ IV-Sekretionssystem bezeichnet, wird anschließend aktiviert und funktioniert hierbei ähnlich einer „molekularen Spritze“: Sie injiziert über einen rezeptorabhängigen Mechanismus einen bakteriellen Giftstoff, das sogenannte CagA-Protein, an der Unterseite der Wirtszellen. Das eingeschleuste CagA wiederum programmiert die Wirtszelle so um, dass Krebs entstehen kann. Darüber hinaus beeinflusst das Protein das menschliche Immunsystem, so dass die Bakterien nicht erkannt und dadurch auch nicht eliminiert werden – ein entscheidender Weg für das dauerhafte Überleben von H. pylori im menschlichen Magen.
Neuer Ansatz für eine Therapie gegen Magenkrebs
Dr. Tegtmeyer geht davon aus, dass diese Befunde wichtige neue Ansatzpunkte für eine anti-bakterielle Therapie aufzeigen, da HtrA und CagA sich hervorragend als neue Wirkstoffziele eignen. Die Arbeitsgruppe hat bereits begonnen, spezifische Hemmstoffe gegen HtrA zu testen. „Wir hoffen, dass entsprechende Wirkstoffe eine Infektion entweder komplett verhindern oder die CagA-Injektion unterbinden“, erläutert Tegtmeyer.
The publication is the result of several years of research work with Prof. Dr. Silja Wessler from the University of Salzburg and Prof. Dr. Dr. Steffen Backert at the FAU’s Chair of Microbiology, which was funded by the German Research Foundation within the framework of the Collaborative Research Centre „Switch Cells for the Dissolution of Ignition“ (SFB1181/TPA04 and Z02) and DFG TE 776 3-1 and carried out in cooperation with other working groups from Germany, Italy, Portugal and Switzerland.
Further Information:
Dr. Nicole Tegtmeyer
Phone: 09131/85- 28988
nicole.tegtmeyer@fau.de
